Estrutura de Lewis de C20H18O7 (Sesamolina):
| ||
Gerando estruturas de LewisPara gerar um diagrama de estrutura de Lewis, insira sua fórmula química e clique em "Gerar". Na fórmula química, você pode usar:
O gerador de estrutura de Lewis exibe diagramas de estrutura molecular para compostos químicos. O que é uma estrutura de Lewis?Uma estrutura de Lewis (também chamada de fórmula de pontos de Lewis) é um diagrama que mostra a ligação entre átomos e os pares solitários de elétrons em uma molécula. As ligações são mostradas como linhas entre átomos: uma linha simples para uma ligação simples, uma linha dupla para uma ligação dupla e uma linha tripla para uma ligação tripla. Pares solitários são mostrados como um par de pontos ao lado do átomo. Para um radical, um elétron livre é mostrado como um único ponto.Como criar uma estrutura de pontos de Lewis?Aqui está um guia passo a passo detalhado sobre como desenhar uma estrutura de pontos de Lewis usando CO₂ (dióxido de carbono) como exemplo:Etapa 1: Conte o número total de elétrons de valênciaPara CO₂: o carbono tem 4 elétrons de valência, cada oxigênio tem 6 elétrons de valência. Etapa 2: Determinar o átomo centralO átomo central é geralmente o átomo menos eletronegativo (excluindo o hidrogênio). O carbono é menos eletronegativo que o oxigênio, portanto, o carbono é o átomo central. 
Etapa 3: Desenhe ligações simples entre o átomo central e os átomos circundantesConecte o carbono a cada oxigênio com uma ligação simples. Cada ligação simples utiliza 2 elétrons. 
Etapa 4: Adicionar pares solitários aos átomos externosComplete o octeto para cada átomo de oxigênio adicionando pares isolados. Cada oxigênio precisa de 8 elétrons no total. 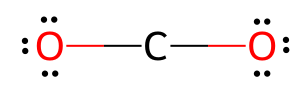
Etapa 5: Verifique se o átomo central possui octeto completoAtualmente, o carbono possui apenas 4 elétrons (2 ligações). Ele precisa de 8 elétrons para completar seu octeto. 
Etapa 6: Verifique a estrutura de LewisVerifique se: |
